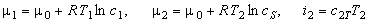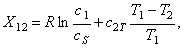7. Колебания при кристаллизации фосфорной кислоты
|
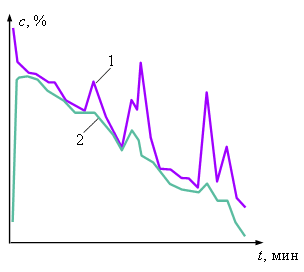
В процессе кристаллизации фосфорной кислоты из растворов (85-87 %) при понижении температуры могут наблюдаться колебания концентрации фосфорной кислоты (см. рисунок).
Для объяснения описанного явления рассмотрим движущую силу процесса кристаллизации (3.8), полученную на основе аппарата механики гетерогенных сред и анализа производства энтропии. С учётом соотношений для химических потенциалов и энтальпии
Поскольку процесс кристаллизации ведётся при пересыщении, концентрация раствора фосфорной кислоты больше равновесной, и, следовательно, первое слагаемое в правой части уравнения (3.9) положительно. Величина теплового эффекта при кристаллизации фосфорной кислоты достигает значения 223,4 кДж/кг, поэтому температура кристаллов фосфорной кислоты Т2 постоянно превышает температуру раствора Т1, и, следовательно, второе слагаемое в правой части уравнения (3.9) отрицательно. В зависимости от того, какое из слагаемых в тот или иной момент времени больше по абсолютной величине, процесс роста кристаллов может чередоваться с их растворением не смотря на то, что раствор остаётся при этом пересыщенным. |