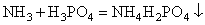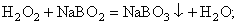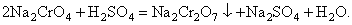5. Осцилляторы при кристаллизации малорастворимых веществ
|
5.2. Кристаллизация малорастворимых веществ
Кристаллизация малорастворимых веществ представляет особый случай кристаллизации из
растворов. Деление веществ на хорошо растворимые и малорастворимые носит условный характер. Обычно к
малорастворимым относятся вещества, растворимость которых в воде меньше растворимости гипса (т.е., меньше 10 г/л).
Отметим, что число соединений, имеющих указанную растворимость, достаточно велико; эти соединения осаждаются
в виде кристаллов.
Кристаллизацию в результате химической реакции осаждения широко используют как в крупнотоннажных производствах (например, в производстве сульфата аммония из аммиака и серной кислоты), так и в небольших производствах (например, получение пербората натрия). Другое важное отличие процессов кристаллизации хорошо растворимых и малорастворимых веществ связано с широтой концентрационного диапазона и степенью пересыщения в ходе кристаллизации. Кристаллизация хорошо растворимых веществ ведётся при малых величинах пересыщения, т.е. в условиях, близких к равновесным. Кристаллизация малорастворимых веществ ведётся при больших величинах пересыщения, т.е. при существенном удалении от равновесия. Так например, в случае плохо растворимых гидроксидов железа, аммония, хрома и др. степень пересыщения может составлять от нескольких единиц до 400000 % (мас.) и более. |