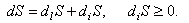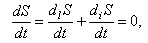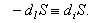5. Краткий исторический обзор
|
5.3. Развитие термодинамики необратимых процессов
Задача термодинамики необратимых процессов - изучение неравновесных процессов для состояний, близко или далеко удалённых от равновесия, в которых это удаление удерживается благодаря обмену веществом и энергией системы с окружающей средой. Неравновесная термодинамика рассматривает системы в аспекте их динамики и, следовательно, имеет дело с системами, которые не находятся в состоянии покоя. Самоорганизация возможна только в неравновесных системах. Однако неравновесную термодинамику нельзя понять без знания главных положений равновесной термодинамики. Формулировка Р. Клаузиуса без труда обобщается на открытые системы. Только в открытой системе в приращении энтропии dS необходимо различать два члена: первый ( dlS ) описывает перенос энтропии через границу системы в силу обмена системы с окружающей средой веществом и энергией, второй ( diS ) означает энтропию, произведённую в системе. Согласно второму началу термодинамики (1.1) производство энтропии системы ( diS ) положительно:
В стационарном состоянии все параметры системы, в том числе и энтропия, не меняются во времени, т.е.
Огромной заслугой неравновесной термодинамики является осознание того факта, что неравновесность может быть причиной порядка. Таким образом, удалось связать такие понятия, как самоорганизация и хаос, или порядок и беспорядок. Оказалось, что необратимые (неравновесные) процессы в открытых системах могут приводить к возникновению нового типа динамических состояний материи - диссипативным самоорганизующимся структурам. Неравновесная термодинамика сформировалась в самостоятельную область естествознания в 50-х годах ХХ столетия. Колоссальный шаг в развитии неравновесной термодинамики был сделан в 1931 г. Л. Онзагером, который сформулировал принцип симметрии кинетических коэффициентов в термодинамических потоках и в 1968 г. был удостоен Нобелевской премии по химии. Особенно бурное развитие термодинамики необратимых процессов началось вскоре после второй мировой войны в значительной мере благодаря работам голландско-бельгийской школы (И. Пригожин, С. де Гроот, П. Мазур и др.). За разработку теории диссипативных структур И. Пригожину была присуждена в 1977 г. Нобелевская премия. |