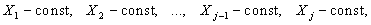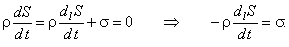|
Согласно второму началу термодинамики (1.1) изолированная физико-химическая система
с течением времени стремится к состоянию равновесия, характеризуемому максимумом энтропии. Состояние равновесия
выступает как своеобразная "приманка" для неравновесных состояний.
Открытые системы, обменивающиеся веществом и энергией с окружающей средой,
также могут стремиться к равновесию. Однако граничные условия, наложенные на систему, не позволят ей достичь
равновесия. В то же время открытые системы могут эволюционировать к состояниям, не зависящим от времени.
Такие состояния называются стационарными.
Более точное определение стационарности было дано де Гроотом:
термодинамическая система находится в стационарном состоянии j-го порядка, если из N независимых
сил, действующих в системе, j искусственно фиксированы (постоянны)
а также отсутствуют потоки, сопряжённые с силами, не фиксированными искусственно
и все параметры системы принимают постоянные во времени значения. Таким образом, состояние термодинамического
равновесия по де Грооту соответствует стационарному состоянию 0-го порядка, поскольку все потоки в состоянии
термодинамического равновесия отсутствуют.
Стационарное состояние, к которому может эволюционировать открытая система,
заведомо является неравновесным состоянием, в котором диссипативные процессы происходят с ненулевыми
скоростями [4]. Но все величины, описывающие систему (температура, концентрация и др.),
перестают в нём зависеть от времени. Не зависит от времени в стационарном состоянии и энтропия системы.
В разделе "Характеристика производства энтропии" было показано,
что в стационарном состоянии производство энтропии неравновесных систем компенсируется отрицательным потоком
энтропии из внешней среды:
То есть, стационарность диссипативных процессов в системе поддерживается постоянным потоком извне вещества и энергии.
|